Segunda-feira, 21 de abril de 2025 | Porto Velho (RO)
Terça-feira, 18 de agosto de 2020 - 12h58
A Agência Nacional de Vigilância
Sanitária (Anvisa) autorizou a Jansen-Cilag, unidade farmacêutica da Johnson
& Johnson, a realizar testes clínicos no Brasil para o desenvolvimento de
vacina contra a covid-19. O estudo global prevê a inclusão de até 60 mil
voluntários, sendo 7 mil no Brasil, distribuídos nos estados de São Paulo, Rio
Grande do Sul, Rio de Janeiro, Paraná, Minas Gerais, Bahia e Rio Grande do
Norte.
Em nota divulgada hoje (18), a
Anvisa informou que os dados que embasaram a autorização incluíram estudos não
clínicos com a vacina e dados não clínicos e clínicos acumulados de outras
vacinas que utilizam a mesma modelagem. Os estudos da Jansen-Cilag foram
iniciados em julho nos EUA e na Bélgica. De acordo com a agência, o ensaio
clínico será conduzido em etapas e cada etapa só será iniciada se os resultados
que estiverem disponíveis no momento forem satisfatórios.
Este é o quarto estudo de vacina
contra o novo coronavírus autorizado pela Anvisa no Brasil. No dia 2 de junho,
a agência autorizou o ensaio clínico da vacina desenvolvida pela empresa AstraZeneca
e pela Universidade de Oxford, do Reino Unido; no dia 3 de julho, o da vacina
desenvolvida pela Sinovac Biotech, da China, em parceria com o Instituto
Butantan; e no dia 21 de julho, o das vacinas desenvolvidas pela BioNTech, da
Alemanha, e Wyeth/Pfizer, dos Estados Unidos.
A potencial vacina da
Jansen-Cilag, denominada Ad26.COV2.S, é composta de um vetor recombinante, não
replicante, de adenovírus tipo 26 (Ad26), construído para codificar a proteína
S (Spike) do vírus Sars-CoV-2 (o novo coronavírus).
O ensaio clínico aprovado é um
estudo de fase 3, randomizado, duplo cego, controlado por placebo, para avaliar
a eficácia e a segurança de Ad26.COV2.S na prevenção de covid-19 em adultos com
18 anos ou mais. Cada participante receberá uma dose única da vacina ou
placebo. O recrutamento dos voluntários é de responsabilidade dos centros que
conduzem a pesquisa.
 Segunda-feira, 21 de abril de 2025 | Porto Velho (RO)
Segunda-feira, 21 de abril de 2025 | Porto Velho (RO)
Ministério da Saúde retoma maior pesquisa sobre Covid no Brasil
A partir desta segunda-feira (11), pesquisadores a serviço do Ministério da Saúde darão início à coleta de dados para uma nova fase do maior estudo
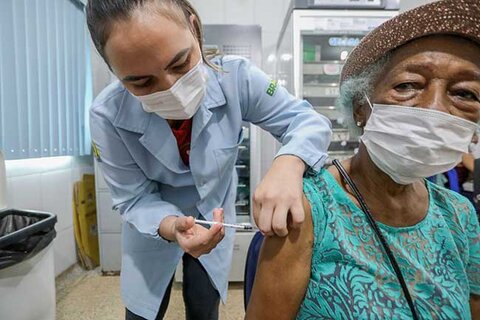
Vacina bivalente contra a covid-19 começou a ser aplicada em Porto Velho
A Prefeitura de Porto Velho, através da Secretaria Municipal de Saúde (Semusa), começou hoje a vacinação bivalente contra a covid-19 em idosos acima d
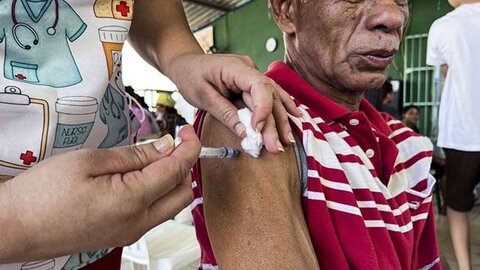
Porto Velho inicia vacinação bivalente para idosos a partir de 60 anos na segunda-feira (27)
A Prefeitura de Porto Velho, através da Secretaria Municipal de Saúde (Semusa), inicia na segunda-feira (27) a vacinação bivalente contra a covid-19
 Segunda-feira, 21 de abril de 2025 | Porto Velho (RO)
Segunda-feira, 21 de abril de 2025 | Porto Velho (RO)